LICEO PEDAGÓGICO NUEVA GENERACIÓN
GRADO DÉCIMO 10° QUÍMICA
Química tiene un porcentaje dentro del área de
Ciencias naturales para grado 10º en mi asignatura es del 100%, al finalizar el
año lectivo se calculará la nota del área de acuerdo a dicho porcentaje.
La
asignatura Química se valorará por periodo de la siguiente manera:
10% Convivencia Escolar: Compañerismo, actitud
de trabajo, colaboración y participación del aprendizaje colectivo, trabajo
independiente (Virtual), cumplimiento, respeto. Asistencia, etc.
20% Evaluación de competencias (Prueba del
periodo)
70% Trabajo colaborativo (grupal - virtual), participación en clase, memorias y trabajos extra clase (Cuaderno de memorias), laboratorios (si se llevan a cabo), Pruebas cortas (si se llevan a cabo), valoración actitudinal
* Análisis Cuantitativo: este análisis identifica que clase de elementos forman un compuesto así por ejemplo si tenemos la molécula de agua decimos que está formada por dos átomos de hidrógeno y uno de oxígeno
GRADO DÉCIMO 10° QUÍMICA
MÉTODO CIENTÍFICO
El método científico es un método de
investigación usado principalmente en la producción de conocimiento en las ciencias.
Para ser llamado científico, un método de investigación debe basarse en lo empírico y en la medición,
sujeto a los principios específicos de las pruebas de
razonamiento. Según el Oxford English Dictionary, el método
científico es: «un método o procedimiento que ha caracterizado a la ciencia
natural desde el siglo XVII, que consiste en la observación sistemática,
medición, experimentación, la formulación, análisis y modificación de las hipótesis».
Durante la época
medieval, serían los filósofos, físicos, matemáticos, astrónomos y médicos del
mundo islámico quienes hicieran suya, desarrollaran y
difundieran la herencia de la filosofía griega -entre otros Alhazen, Al-Biruni y Avicena-.
También se debe reconocer a quienes contribuyeron a la difusión de dichos
conocimiento por Europa; figuras como Roberto Grosseteste y Roger Bacon junto
con la imprescindible labor de la Escuela de Traductores de Toledo.
Pero no sería hasta la edad moderna cuando
se consolidara una nueva filosofía natural. Descartes (1596-1650) en su obra el Discurso del método define por primera
vez las reglas del método para dirigir
bien la razón y
buscar la verdad en
las ciencias. Aún con diferencias notables fueron muchos los que
defendieron la necesidad de un método que permitiera la investigación de la
verdad.
Desde un punto de vista empírico o científico tal y
como ahora lo entendemos se debe mencionar a precursores del método científico
como Leonardo da Vinci (1452-1519), Copérnico (1473-1543), Kepler (1571-1630) y Galileo
Galilei (1564-1642)
quienes aplicaban unas reglas metódicas y sistemáticas para alcanzar la verdad.
Galileo Galilei contribuyó a reforzar la idea de separar el conocimiento científico de la autoridad,
la tradición y
la fe.
La filosofía reconoce numerosos métodos, entre los que
están el método por definición, demostración, dialéctico, trascendental, intuitivo, fenomenológico, semiótico, axiomático, inductivo.
La filosofía de la ciencia es la que, en
conjunto, mejor establece los supuestos ontológicos y metodológicos de
las ciencias, señalando su evolución en la historia de la ciencia y los
distintos paradigmas dentro de los que se desarrolla.
SISTEMA INTERNACIONAL DE UNIDADES O MEDIDAS
DESCARGAR DOCUMENTO COMPLETO
NTC 1000
PROPIEDADES DE LA MATERIA
_______________________________________________________________________
TEMAS - 2° PERIODO QUÍMICA
EL ATOMO Y LOS MODELOS ATÓMICOS
Propiedades Atómicas y Tendencia Periódicas
Tamaño atómico
Tamaño de los iones
Electronegatividad
Tendencias periódicas
Grupo I: Metales alcalinos
Grupo II: Metales alcalinotérreos
Grupos III al XII: Metales de transición
Grupo XIII
Grupo XIV
Grupo XV
Grupo XVI
Grupo XVII: Halógenos
Grupo XVIII: Gases nobles
Valencia y Estados de oxidación
Los Estados de oxidación
- __________________________________________________________________________________________2021CUARTO PERIODO GRADO DÉCIMO(4° PERIODO GRADO 10°)CONTENIDOS CURRICULARES PARA ÁREAS ESPECIFICAS DE LAS CIENCIAS NATURALES
TEMAS - 4° PERIODO QUÍMICA Nomenclatura química de los compuestos inorgánicos
La Unión Internacional de Química Pura y Aplicada (IUPAC) ha recomendado una serie de reglas aplicables a la nomenclatura química de los compuestos inorgánicos; estas se conocen comúnmente como El libro rojo. Idealmente, cualquier compuesto debería tener un nombre del cual se pueda extraer una fórmula química sin ambigüedad ya sea diferente manera para su forma química del desarrollo. En castellano puede consultarse el "Resumen de las nomas IUPAC 2005 de nomenclatura de química inorgánica para su uso en enseñanza secundaria y recomendaciones didácicas" de la RSEQ (Real Sociedad Española de Química).También existe una nomenclatura IUPAC para la química orgánica. Los compuestos orgánicos son los que contienen carbono, comúnmente enlazados con hidrógeno, oxígeno, nitrógeno, azufre, boro, fósforo y algunos halógenos. El resto de los compuestos se clasifican como compuestos inorgánicos, los más comunes son los minerales. Estos se nombran según las reglas establecidas por la IUPAC.Los compuestos inorgánicos se clasifican según la función química que contengan y por el número de elementos químicos que los forman, con reglas de nomenclatura particulares para cada grupo. Una función química es la tendencia de una sustancia a reaccionar de manera semejante en presencia de otra. Por ejemplo, los compuestos ácidos tienen propiedades químicas características de la función ácido, debido a que todos ellos tienen el ion hidrógeno y que dona H+; y las bases tienen propiedades características de este grupo debido al ion OH-1 presente en estas moléculas y que recibe electrones. Las principales funciones químicas son: óxidos, bases, ácidos y sales.Se aceptan tres tipos de nomenclaturas para nombrar compuestos químicos inorgánicos:- Nomenclatura sistemática, con prefijos / atomicidad
- Nomenclatura stok con números romanos
- Nomenclatura tradicional, clásica o antigua
Nomenclatura sistemática, con prefijos / atomicidad
También llamada nomenclatura por atomicidad, estequiométrica o de IUPAC. Se basa en nombrar a las sustancias usando prefijos numéricos griegos que indican la atomicidad de cada uno de los elementos presentes en cada molécula. La atomicidad indica el número de átomos de un mismo elemento en una molécula, como por ejemplo el agua con fórmula H2O, que significa que hay un átomo de oxígeno y dos átomos de hidrógeno presentes en cada molécula de este compuesto, aunque de manera más práctica, la atomicidad en una fórmula química también se refiere a la proporción de cada elemento en una cantidad determinada de sustancia. En este estudio sobre nomenclatura química es más conveniente considerar a la atomicidad como el número de átomos de un elemento en una sola molécula.La manera precisa de nombrar estos compuestos es: prefijo-nombre genérico + prefijo-nombre específicoLos prefijos son palabras que anteponen al prefijo nombre del compuesto y representan el número de átomos que hay en la molécula del elemento. Existen diferentes prefijos los cuales provienen del griego y a continuación se presenta el número de átomos al que hace referencia el prefijo.- El prefijo mono- normalmente se elude salvo que haya posibilidad de confusión.
- Por ejemplo, CrBr3: tribromuro de cromo; CO: monóxido de carbono
- En casos en los que en vez de átomos se trate de grupos de átomos como compuestos tales como sales dobles y triples, oxisales y similares, se pueden emplear los prefijos bis-, tris-, tetraquis, pentaquis, hexaquis, etc.
- Por ejemplo la fluorapatita Ca5F (PO4)3 : fluoruro tris(fosfato) de calcio, ya que si se usara el término trifosfato se estaría hablando del anión trifosfato [P3O10]5-, en cuyo caso sería:
- Ca5F (P3O10)3
Nomenclatura Stok con números romanos
Este sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del nombre con números romanos, el estado de oxidación del elemento con “nombre específico”. Si solamente tiene un estado de oxidación, este no se escribe.La valencia (o mejor dicho el estado de oxidación) es la que indica el número de electrones que un átomo pone en juego en un enlace químico; un número positivo cuando tiende a ceder los electrones, y un número negativo cuando tiende a ganar electrones. De forma general, bajo este sistema de nomenclatura, los compuestos se nombran de esta manera: nombre genérico + "de" + nombre del elemento específico + el estado de oxidación.Normalmente, a menos que se haya simplificado la fórmula, la valencia puede verse en el subíndice del otro elemento (en compuestos binarios y ternarios). Los números de valencia normalmente se colocan como superíndices del átomo (elemento) en una fórmula molecular.- Ejemplo: SO3, S+6O3-2, óxido de azufre (VI)
- Ejemplo: Fe2S3, Fe2+3S3-2, sulfuro de hierro (III)
Nomenclatura tradicional, clásica o antigua
En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos. De manera general las reglas son:- Cuando el elemento solo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” o bien se termina el nombre del elemento con el sufijo –ico.
- K2O, óxido de potasio u óxido potásico
- Cuando tiene dos valencias diferentes se usan los sufijos -oso e -ico.
- … -oso cuando el elemento usa la valencia menor: FeO, Fe+2O-2, hierro con la valencia 2, (estado de oxidación +2), óxido ferroso
- … -ico cuando el elemento usa la valencia mayor: Fe2O3, Fe2+3O3-2, hierro con valencia 3, (estado de oxidación +3), óxido férrico.
- Cuando tiene tres distintas valencias se usan los prefijos y sufijos.
- hipo- … -oso (para la menor valencia): P2O, P2+1O-2, fósforo con la valencia 1, (estado de oxidación +1), óxido hipofosforoso
- … -oso (para la valencia intermedia): P2O3, P2+3O3-2, fósforo con valencia 3, (estado de oxidación +3), óxido fosforoso
- … -ico (para la mayor valencia): P2O5, P2+5O5-2, fósforo con valencia 5, (estado de oxidación +5), óxido fosfórico
- Cuando tiene cuatro valencias diferentes se usan los prefijos y sufijos
- hipo- … -oso (para la valencia más pequeña)
- … -oso (para la valencia pequeña)
- … -ico (para la valencia grande)
- per- … -ico (para la valencia más grande)
- Cuando tiene cinco valencias diferentes se usan los prefijos y sufijos:
- hipo- … -oso (para la valencia más pequeña)
- … -oso (para la valencia media-menor)
- … -ico (para la media)
- per- … -ico (para la valencia media-mayor)
- hiper- … -ico (para la valencia mayor)
- TABLA COMPARATIVA DE LAS NOMENCLATURAS QUIMICAS
- TALLERES INTERACTIVOS
- https://www.cerebriti.com/juegos-de-ciencias/nomenclatura-quimica
- https://www.cerebriti.com/juegos-de-ciencias/nomenclatura-quimica2
- https://www.cerebriti.com/juegos-de-ciencias/nomenclatura-tradicional-quimica-inorganica-
Funciones químicas inorgánicas
¿Qué es una función química?
Tal vez sientas que esta unidad está un poco alejada de tu vida, pero los compuestos inorgánicos nos acompañan más cerca de lo que crees. En la sal que le pones a tu comida, en el bicarbonato de sodio que agregas a tus pasteles, y hasta en el adorno de cuarzo que alguna vez te colgaste en el cuello.- Todos los que tengan propiedades químicas y estructuras semejantes formarán parte de una función química. Por ejemplo, los hidróxidos se caracterizan por la presencia de O, H, start superscript, minus, end superscript en su estructura. Del mismo modo, los ácidos en solución acuosa, liberan H, start superscript, plus, end superscript.Como todo lo que se hace en la ciencia, estos compuestos están categorizados es decir, ordenados por criterios. En el caso de las funciones inorgánicas los dos grandes criterios son:1) ¿El elemento químico reacciona con Oxígeno o con Hidrógeno?y2) ¿El elemento químico que reacciona es un metal o un no metal?Como podrás imaginarte, tras la primera división podemos tener compuestos oxigenados y compuestos hidrogenadosEmpecemos por los primeros.
Funciones oxigenadas
Dentro de los compuestos oxigenados, el segundo criterio de clasificación es si el elemento es metal o no metal. Daremos una rápida mirada a la formación de las funciones oxigenadas y luego profundizaremos en cada una de ellas.Óxidos
Un óxido es un compuesto binario porque resulta de la combinación de dos elementos: oxígeno y otro elemento químico de la tabla periódica. Todos reciben la denominación óxido de (elemento), salvo el compuesto con hidrógeno, al que llamamos simplemente agua.Para escribir la formula de un óxido de forma práctica, colocamos el símbolo del elemento químico seguido por el símbolo del oxígeno. Luego, intercambiamos las valencias y las colocamos como subíndices; al elemento químico le corresponde el subíndice 2 (que es la valencia del oxígeno) y el oxígeno llevará la valencia del elemento químico con el que se ha combinado. Si ambos subíndices son pares se simplifican.Por ejemplo, la fórmula del dióxido de carbono es:Dependiendo del tipo de elemento a oxidar, tenemos:Metal + Oxigeno: óxido básico o simplemente óxidoF, e, O Óxido de Hierro(II) u óxido ferrosoLos óxidos metálicos son compuestos que tienen enlaces iónicos, es decir, existe una transferencia de electrones entre sus elementos, que forman un anión con carga negativa y un catión con carga positiva que se atraen por medio de fuerzas electrostáticas.Si el elemento oxidado es un no metal, tendremos un óxido ácido, también llamado anhídrido:C, l, start subscript, 2, end subscript, O, start subscript, 5, end subscript Óxido de Cloro (V) o anhídrido clóricoA diferencia de los óxidos metálicos, los óxidos ácidos poseen enlaces covalentes, es decir, que comparten sus electrones de valencia para lograr su estabilidad química.Resumiendo:Veamos más ejemplos:
¿Qué tipo de compuesto es S, O, start subscript, 2, end subscript?Al ser el azufre un no metal, el S, O, start subscript, 2, end subscript un óxido ácido, también llamado anhídrido.Por el contrario, en el caso del C, a, O, al ser el calcio un metal, se forma un óxido básico.Hidróxidos y ácidos oxácidos
Si un óxido básico reacciona con el agua, se forma un hidróxido. Se les conoce también como bases o álcalis. Aunque están compuestos por tres elementos distintos, los hidróxidos se comportan como compuestos binarios iónicos, ya que el ión negativo o anión hidróxido left parenthesis, O, H, start superscript, minus, end superscript, right parenthesis actúa siempre como una unidad conjunta y se encuentra unido al catión metálico mediante un enlace iónico. Todos reciben la denominación hidróxido de (metal).Para escribir su fórmula, se coloca primero el símbolo del metal, sin subíndice ya que el anión hidróxido left parenthesis, O, H, right parenthesis, start superscript, minus, 1, end superscript tiene una valencia de -1; a continuación, se escribe el grupo funcional hidróxido entre paréntesis, con el subíndice del metal, de esta manera:Por ejemplo:
N, a, left parenthesis, O, H, right parenthesis Hidróxido de sodioC, a, left parenthesis, O, H, right parenthesis, start subscript, 2, end subscript Hidróxido de calcioSi se agrega agua a los óxidos ácidos, se genera un ácido oxácido. compuesto por por tres elementos distintos: hidrógeno, que actúa con su estado de oxidación +1, oxígeno, que siempre actúa con estado de oxidación -2 y un no metal, que actuará con un estado de oxidación positivo.Para escribir la fórmula de un ácido oxácido, se coloca primero el símbolo del hidrógeno; a continuación, el símbolo del no metal y, finalmente, el símbolo del oxígeno. Cada uno lleva un subíndice de forma que la suma total de los estados de oxidación de los elementos químicos de la fórmula sea 0 (cero).donde: a, plus, b, v, minus, 2, c, equals, 0Para esto, te resultará más sencillo hacer una agrupación del óxido que está reaccionando con el hidrógeno del agua. Por ejemplo, para el caso del ácido sulfúrico en el que el Azufre left parenthesis, S, right parenthesis actúa con estado de oxidación +6:Resumiendo: Sal oxisal
Cuando un ácido oxácido reacciona con un hidróxido, el resultado será una sal oxisal + H, start subscript, 2, end subscript, O. Las sales son compuestos iónicos, para formularlas, necesitas escribir en primer lugar el catión, después el anión, y, como ya debes suponer, se intercambian las valencias en forma de subíndices, de esta manera:Por ejemplo, al reaccionar el catión Aluminio left parenthesis, A, l, right parenthesis, start superscript, plus, 3, end superscript con el anión sulfato left parenthesis, S, O, start subscript, 4, end subscript, right parenthesis, start superscript, minus, 2, end superscript, se forma:¿Cómo llegamos hasta aquí? Veamos la ruta gráficamente:Peróxidos
Los peróxidos son compuestos binarios iónicos, generalmente producidos por metales de los grupos IA y IIA. Su grupo funcional es el anión peróxido left parenthesis, O, start subscript, 2, end subscript, start superscript, minus, 2, end superscript, right parenthesis que tiene un enlace oxígeno-oxígeno. Se forman al reaccionar un óxido básico con oxígeno:Por ejemplo:
N, a, start subscript, 2, end subscript, O, start subscript, 2, end subscript Peróxido de Sodio.Los peróxido son óxidos que presentan mayor cantidad de oxígeno que un óxido normal, por lo que son compuestos oxidantes.- Es muy importante recordar que en las fórmulas de los peróxidos no se simplifican los subíndices, pues debe mantenerse el anión peróxido left parenthesis, O, start subscript, 2, end subscript, start superscript, minus, 2, end superscript, right parenthesis.
A continuación veremos la formación de funciones hidrogenadas.Recuerda que luego profundizaremos en las características y ejemplos de cada función.Funciones hidrogenadas
Del mismo modo que las funciones oxigenadas, empezaremos por la combinación de un elemento con el hidrógeno, también llamada reducción.Reacción de un elemento con el hidrógeno
Al igual que en el caso de los óxidos, para escribir la fórmula de un compuesto binario con el hidrógeno, debemos tomar en cuenta la valencia de ambos elementos, pero en el caso de los compuestos hidrogenados, el orden de los elementos varía según su tipo.Si un metal reacciona con el hidrógeno, tendremos un hidruro metálico, y para escribir su fórmula colocamos primero el elemento (con un subíndice sobreentendido de 1) y luego el hidrógeno, con el subíndice de la valencia del metal, de esta manera:Por ejemplo:
Cuando un no metal del grupo de los reaccionan con el hidrógeno, obtenemos un hidrácido. Para escribir la fórmula de un hidrácido, a diferencia de los hidruros metálicos, se coloca primero el símbolo del hidrógeno y luego el símbolo del elemento químico, de esta manera:Por ejemplo:
Gráficamente:- TALLER INTERACTIVO
- TALLER OXIDOS E HIDROXIDOS
- Nomenclatura Tradicional, Sistemática y Stock
- _____________________________________
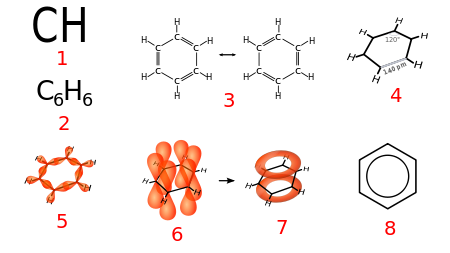
Fórmula empírica
Fórmula empírica (1), Fórmula Molecular (2) y varias fórmulas desarrolladas de la molécula de Benceno: (3) Estructuras de Kekulé (Isómeros de resonancia); (4) Estructura hexagonal Plana, mostrando la longitud y el ángulo de enlace; (5) Enlaces Sigma entre orbitales híbridos sp2; (6) Orbitales atómicos pz; (7) Orbital molecular pi deslocalizado; (8) Anillo bencénicoEn química la fórmula empírica es una expresión que representa la proporción más simple en la que están presentes los átomos que forman un compuesto químico. Es por tanto la representación más sencilla de un compuesto.1 Por ello, a veces, se le llama fórmula mínima y se representa con "fm".
Una fórmula es una pequeña lista de los elementos químicos que forman una sustancia, con alguna indicación del número de moles de cada elemento presente y, a veces, la relación que tiene con otros elementos de la misma sustancia.
Comúnmente, las fórmulas empíricas son determinadas a partir de datos experimentales, de ahí su nombre, fórmula empírica.
Por ejemplo, si observamos que dos moles de hidrógeno reaccionan completamente con un mol de oxígeno para formar dos moles de agua (sin generar otro producto), diríamos que la fórmula molecular del agua es (los subíndices 1 se omiten). Del mismo modo, si observamos que al quemar benceno, siempre obtenemos números iguales de moles de C (contenido en el formado) y de H (monoatómico, existente en el agua producida) podemos decir que la fórmula empírica del benceno es (). Midiendo cuidadosamente el oxígeno consumido, veríamos que todo el oxígeno del y del proviene del aire, por lo que la fórmula empírica del benceno es (). Puede coincidir o no con la fórmula molecular, que indica el número de átomos de cada clase presentes en la molécula.
EJEMPLOS
La molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno, por lo que su fórmula molecular es , coincidiendo con su fórmula empírica.
Para el etano, sin embargo, no ocurre lo mismo, ya que está formado por dos átomos de carbono y seis de hidrógeno, por lo que su fórmula molecular será y su fórmula empírica .
Varios compuestos, como el cloruro de sodio o sal común, carecen de entidades moleculares, pues están compuestos por redes de iones, y por ello, solo es posible hablar de fórmula empírica. Ejemplo: NaCl es la fórmula del cloruro de sodio, e indica que por cada ion sodio, existe un ion cloro.
Cálculo de la fórmula empírica de un compuesto
Para hallar la fórmula empírica de un compuesto,2 primero se obtienen los moles de cada elemento, luego se divide cada uno por el de menor valor y finalmente, por simplificación, se hallan los números enteros más sencillos posibles.
Al realizar el análisis gravimétrico de un determinado compuesto químico se ha encontrado la siguiente composición centesimal: 69,98 % Ag; 16,22 % As; 13,80 % O. Para la determinación de la fórmula empírica o molecular del compuesto se procede de la siguiente manera:
Dividiendo el peso por el peso atómico se obtienen los moles:
- Para la plata 69,98/108= 0,65 moles
- Para el arsénico 16,22/75= 0,22 moles
- Para el oxígeno 13,80/16= 0,86 moles
Cada 0,22 moles de arsénico hay 0,65 moles de plata, para un mol de arsénico 0,65/0,22= 3 moles de plata y 0,84/0,22= 4 moles de oxígeno. La fórmula molecular es y la masa molar y/o masa molecular del compuesto es de 463 g/mol.
_______________________________________________________________________
Balanceo de Ecuaciones Químicas
Qué significa Balancear una Ecuación Química?
Balancear una ecuación química, significa que debe existir una equivalencia entre el número de los reactivos y entre el número de los productos en una ecuación.
"La suma de la masa de las sustancias reaccionantes debe ser igual a la suma de las masas de los productos"
Balanceo por Tanteo
En este método intentaremos equilibrar el número de átomos en la ecuación química, modificando los valores de las sustancias presente de uno o ambos lados, para que exista igualdad entre el número de átomos de las sustancias reaccionantes y las sustancias producidas. Es un método de ensayo y error.
Para saber si esta ecuación está balanceada, debemos contar el número de átomos de uno y otro lado; si el total es el mismo de ambos lados entonces consideramos que la ecuación está balanceada
Reglas para balancear una ecuación por método de tanteo.
Para balancear una ecuación al tanteo, tenemos que seguir las siguientes reglas:
a. No agregaremos elementos que no pertenezcan a la ecuación.
b. No modificaremos los radicales de los elementos de la ecuación, es decir, si de un lado el hidrógeno tiene un radical 2, debe seguir con el radical 2.
c. Sí podemos expresar al aumento de átomos agregando el número de átomos de alguno de los compuestos de la mezcla. Así, si queremos expresar que hay 4 átomos de ácido clorhídrico, escribiremos 4HCl.
d. Es conveniente comenzar el balanceo por los elementos que sólo aparecen una vez en cada miembro, dejando al último los que aparecen más de una vez, si es necesario.
e. El hidrógeno y el oxígeno son de los últimos elementos a considerar para el balanceo.
Balanceo por Redox
Una reacción de óxido-reducción no es otra cosa que una pérdida y ganancia de electrones, es decir, desprendimiento o absorción de energía (presencia de luz, calor electricidad, etc.) En una reacción si un elemento se oxida, también debe de existir un elemento que se reduce.
En una reacción de redox el agente oxidante acepta electrones ( es el que se reduce) y el agente reductor suministra electrones (es el que se oxida).
Para poder balancear por método de redox es importante recordar como determinar la cantidad de átomos de un elemento en un compuesto, así como determinar la cantidad de número de oxidación de cada elemento y conocer los pasos del método de redox.
Pasos:
1.- Verificar que la ecuación este bien escrita y completa.
2.- Colocar los números de oxidación en cada uno de los elementos.
3.- Observar que números de oxidación cambiaron (un elemento se oxida y uno se reduce).
4.- Escribir la diferencia de números de oxidación de un mismo elemento.
5.- Multiplicar la diferencia de números de oxidación por los subíndices correspondientes de cada elemento.
6.- Cruzar los resultados
7..- Colocar los resultados como coeficientes en el lugar correspondiente.
8.-Completar el balanceo por tanteo.
9.- Verifica la cantidad de átomos en cada miembro de la ecuación.
10.-En caso de que todos los coeficientes sean divisibles se reducen a su mínima expresión.














































No hay comentarios.:
Publicar un comentario